Prédire la réponse du Patient à un traitement à base de gemcitabine dans le Cancer du Pancréas
Le GemciTest® est un diagnostic in-vitro (DIV) innovant et non invasif qui permet de prédire la réponse à un traitement de première ligne à base de gemcitabine chez les patients souffrant d’une forme de cancer du pancréas : l’adénocarcinome pancréatique métastatique (mPDAC). Ce DIV, marqué CE et basé sur une combinaison de marqueurs ARN, identifie parmi les patients diagnostiqués d’un mPDAC ceux qui ne présentent pas de bénéfice clinique en suivant un traitement de première intention à base de gemcitabine, seule ou en combinaison. Le GemciTest est un test prédictif de l’efficacité de la gemcitabine.

Le cancer du pancréas et les thérapies disponibles
Le cancer du pancréas est une maladie « silencieuse » qui ne provoque aucun symptôme dans ses premiers stades. De très nombreux patients présentent des métastases au moment du diagnostic. Pour eux, la chimiothérapie demeure la seule option thérapeutique.
Ce cancer présente un mauvais pronostic : 90 à 95% des patients atteints d’un cancer du pancréas succomberont à la maladie à court ou moyen terme (taux de survie à 5 ans = 5-10%).
Selon une étude parue en 2021 réalisée par l’association PANCAN et des chercheurs des Cancer Commons et MD Anderson Cancer Center, le cancer du pancréas devrait devenir la deuxième cause de décès par cancer avant 2030, et dépasser ainsi le nombre de décès causés par le cancer colorectal. La première cause de décès par cancer reste due au cancer du poumon.
Plusieurs thérapies sont aujourd’hui disponibles dans le traitement du cancer du pancréas.
Par exemple, la gemcitabine, molécule générique, est utilisée dans le traitement du cancer du pancréas localement avancé ou métastatique, généralement pour des cancers de stade 2 (SP 2) ou plus.
Des combinaisons thérapeutiques de gemcitabine plus erlotinib et gemcitabine plus nab-paclitaxel, ont été approuvés en raison d’une augmentation de la survie, néanmoins modeste comparativement à la gemcitabine seule, soit des gains médians de survie de 0,3 et 1,8 mois respectivement, les gains absolus à 1 an correspondant à 6 et à 13 %.
Le FOLFORINOX (une combinaison de quatre chimiothérapies) est la première avancée majeure dans la prise en charge du cancer du pancréas puisque la survie globale et les temps de survie sans récidive ont presque doublé (Conroy T et al. N Engl J Med 2011). Cependant, la population étudiée dans les études cliniques récentes est limitée aux patients en “bon état général” (SP 0 ou 1)1 avec une fonction hépatique satisfaisante2, excluant ainsi un grand nombre de patients atteints de cancer du pancréas métastatique. En outre, les toxicités secondaires au traitement par FOLFORINOX sont importantes3. Ainsi, le profil d’innocuité et de toxicité du traitement par FOLFORINOX est jugé moins positif que celui de la gemcitabine.
D’autres approches médicales sont possibles, telle que la médecine de précision, basée sur des biomarqueurs ou des diagnostics moléculaires. Utilisée dans le cancer du sein depuis plusieurs années, cette approche permet d’améliorer la prise en charge des patients, de prescrire aux personnes le traitement le plus adapté, donc le plus efficace (évaluation de la toxicité, de la résistance, etc.), et peut aussi participer à la réduction des coûts de santé.
1. Dans le cancer du pancréas non résécable, le choix du traitement de chimiothérapie se fait grâce aux échelles d’autonomie (PS : performance status), qui permettent d’évaluer l’état général du patient. Les plus couramment utilisées sont l’échelle de Karnofsky et l’échelle de Zubrod (ou ECOG : Eastern Cooperative Oncology Group). Le choix du traitement est complété par les données acquises lors du diagnostic (voir § “Description des utilisations et des modes d’utilisation”).
2. taux de bilirubine inférieurs à 1,5 fois la normale.
3. Le taux de neutropénie de grade 3-4 est de 45,7 % vs 21 % dans le groupe gemcitabine (p<0,001) avec 5,4 % de neutropénie fébrile contre 1,2 %. De plus, la survenue de diarrhées de grade 3-4 (12,7% vs 1,8%) et de neuropathies périphériques de grade 3 (9% vs 0%) est beaucoup plus fréquente (Conroy T et al.).
Intérêt médical du GemciTest®
Sans l’aide de biomarqueurs pharmacogénomiques, les études cliniques montrent un taux médian de survie de 6,5 mois chez les patients atteints d’un cancer du pancréas et traités par gemcitabine, avec un taux de survie à un an inférieur à 20%.
Dans un essai clinique antérieur, dans lequel des patients diagnostiqués avec un cancer du pancréas (grade 3-4, non opérable, métastatique ou non) ont été traités par gemcitabine en première ligne, des échantillons de sang ont été collectés avant traitement et la survie globale (OS) et la survie sans progression (PFS) ont été mesurées.
Dans ce cadre, ACOBIOM a analysé les profils transcriptomiques des prélèvements de 60 patients et a sélectionné un panel de biomarqueurs ARN permettant d’identifier les populations de patients qui, respectivement, ont bénéficié ou pas d’un traitement à base de gemcitabine (OS supérieure à 8,7 mois, PFS supérieure à 3,5 mois).
Des validations cliniques ont été effectuées sur une large cohorte de 336 patients (moyenne d’âge : 68,7 ans ; 37-88) provenant de 2 études cliniques rétrospectives (dont l’essai GemciPANC, NCT03599154CGFL) et de 2 biobanques (Carbone Cancer Center (Université de Madison, Wisconsin, USA) ; CHU de Toulouse (consortium BACAP, NCT02818829, France)). Ces cohortes comprenaient des patients traités en première ligne avec un régime à base de gemcitabine ou de fluoropyrimidine (5FU).
A partir de ces analyses et des données de vie réelle (real-world data ; RWD), ACOBIOM a ainsi développé le GemciTest®.

Le GemciTest® concerne les patients atteints d’un cancer du pancréas métastatique ou localement avancé, et ses résultats sont obtenus dans un délai d’une semaine.
Ce diagnostic in-vitro marqué CE est un exemple des avantages des tests moléculaires qui peuvent prédire la réponse du patient au traitement. C’est un exemple des avantages de la médecine de précision dans le traitement du cancer du pancréas.
Performances analytiques du GemciTest®
Les performances analytiques du GemciTest® (efficacité du diagnostic in-vitro, répétabilité, variabilité inter et intra-échantillon, etc.) et ses performances cliniques ont été confirmées (selon les recommandations des autorités sanitaires).
Les résultats des validations cliniques effectuées sur des données de vie réelle de patients (real-world data ; RWD) montrent que ces patients, présentant un bénéfice clinique (OS >8.7 mois; PFS ≥3.5 mois) et identifiés par GemciTest® (30%), avaient une survie sans progression (PFS) significativement plus longue (5,3 mois contre 2,8 mois) et une survie globale (OS) plus longue (10,4 mois contre 4,8 mois).
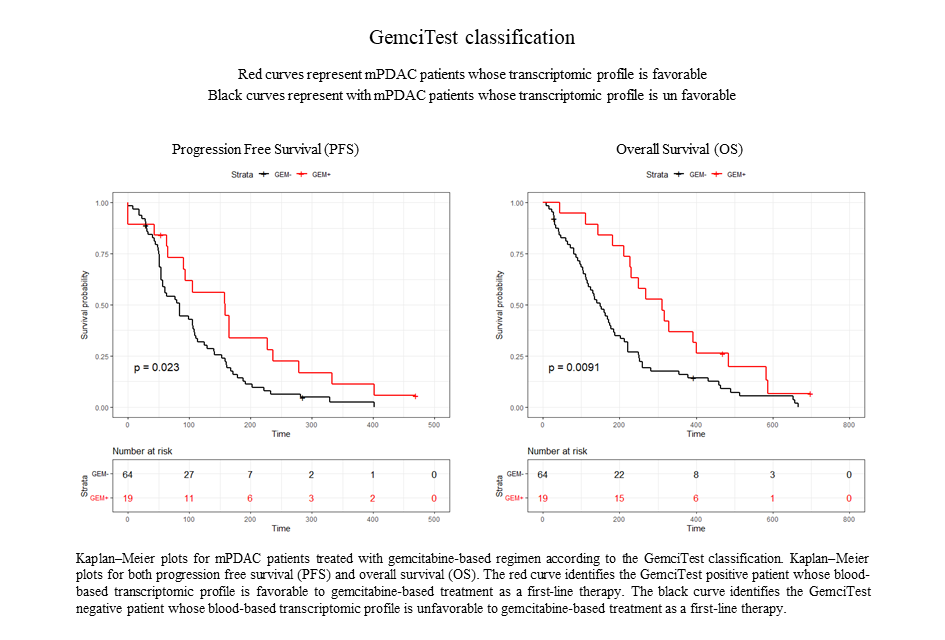
Un article scientifique présentant ces résultats a été publié en avril 2023 dans le Journal of Gastrointestinal Oncology.
Cette étude a été réalisée avec le soutien du Dr Noelle LoConte (Université du Wisconsin, Carbone Cancer Center, USA), du Pr Jérôme Cros (Hôpital Beaujon, APHP, Paris, France), du Pr Barbara Bournet et du Dr Cindy Canivet (BACAP, hôpital de Toulouse, France), du Pr François Ghiringhelli (essai clinique GemciPANC, CGFL, Centre Georges-François Leclerc, Dijon, France), et du Pr Jean-Baptiste Bachet (Hôpital La Pitié-Salpêtrière, APHP, Paris, France).
Par ailleurs, ces résultats ont été présentés dans une vidéo par le Dr LoConte.
Les bénéfices apportés par le GemciTest®
L’utilisation du GemciTest® aura des répercussions importantes aux niveaux médical, sociétal et économique :
– Faciliter la prise de décision en guidant le clinicien vers le choix de la thérapie optimale ;
– Identifier la sous-population de patients atteints de cancer du pancréas métastatique qui bénéficieront d’une thérapie à base de gemcitabine en première ligne de traitement, avec une survie médiane de 13 mois ;
– Améliorer la qualité de vie des patients identifiés par le GemciTest pendant leurs traitements (la gemcitabine est l’un des traitements les moins toxiques) ;
– Offrir une meilleure qualité de vie aux aidants (la gemcitabine est administrable à domicile) ;
– Contrôler et anticiper les déplacements anxiogènes dans les hôpitaux (déjà surchargés) et le risque de développer des maladies nosocomiales ;
– Réduire et/ou contrôler les coûts globaux de santé dans le cancer du pancréas (la gemcitabine est une des thérapies les moins coûteuses) ;
– Éviter la prescription de thérapies inefficaces, toxiques et coûteuses.
Aujourd’hui, les acteurs de santé sont confrontés à plusieurs problèmes majeurs : la réduction des dépenses globales de santé, la nécessité croissante d’améliorer l’efficacité des thérapies, tout en respectant ou en améliorant la qualité de vie du patient pendant le traitement (réduction des délais de traitement et des inégalités dans ce traitement entre territoires).
Les diagnostics prédictifs de la réponse du patient à l’une des thérapies sont l’une des solutions les plus efficaces pour répondre à ces besoins en aidant les médecins à choisir le traitement le plus efficace ou le plus approprié pour le patient.
L’utilisation du GemciTest® en association avec la Gemcitabine permettrait de réduire les coûts, mais serait surtout bénéfique pour les patients, en réduisant la toxicité et les effets secondaires et en améliorant leur qualité de vie pendant le traitement.

