Prendre en compte les différences biologiques des patients
L’objectif de la médecine de précision est “d’optimiser une intervention préventive, diagnostique ou thérapeutique spécifique dans une sous-population donnée de patients, qui serait la plus susceptible d’en bénéficier” (citation de “California Initiative to Advance Precision Medicine”).
Le développement de la médecine de précision repose sur l’utilisation d’un grand nombre de données (Big data) et constitue une transformation considérable des pratiques médicales et des concepts sous-jacents. Fournir des valeurs prédictives sur la qualité et l’efficacité d’un traitement permettra d’améliorer significativement les soins médicaux et la qualité de vie du patient pendant le traitement, mais aussi de réduire les coûts d’hospitalisation, les dépenses en recherche biomédicale et dans l’industrie pharmaceutique.
Biomarqueurs et données cliniques pour optimiser l’efficacité des thérapies
Selon le “National Institute of Health” (NIH, USA) et la “Precision Medicine Initiative”, la médecine de précision est ”une approche émergente pour le traitement et la prévention des maladies qui tient compte de la variabilité individuelle des gènes, de l’environnement et du mode de vie pour chaque personne “.
L’approche de la médecine de précision est à l’opposé de l’approche “one-size-fits-all” (le même traitement pour tout individu), dans laquelle les stratégies de traitement ou de prévention des maladies sont basées sur le modèle d’une personne moyenne, avec peu de considération pour les individus.
La médecine de précision rend la prévention et la thérapie plus efficaces ou mieux adaptées à chaque personne en tenant compte des différences individuelles.
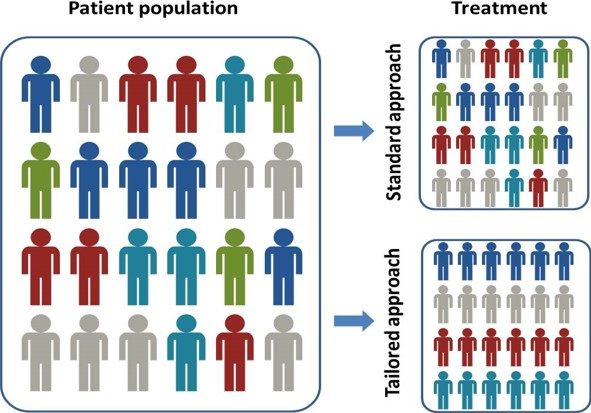
Par exemple, l’oncologie est le domaine médical dans lequel la médecine de précision est déjà appliquée en routine. Les sous-populations de patients sont différenciées par l’identification de marqueurs moléculaires ou d’anomalies moléculaires. Ces classifications moléculaires permettent de cibler les thérapies. Ainsi, les médecins distinguent différents types de cancer, associés à des thérapies spécifiques.
C’est le cas du cancer du sein et du traitement au trastuzumab. Cette thérapie est particulièrement efficace pour bloquer la surexpression de la protéine HER2 (HER2+) et, par conséquent, la croissance tumorale. Par exemple, une étude clinique récente a montré que 89% des patientes atteintes d’un cancer du sein HER2+ à un stade précoce et traitées par le trastuzumab adjuvant ne présentaient aucune maladie après 4 ans. Dans le traitement du cancer du sein, d’autres diagnostics moléculaires sont également utilisés en routine pour déterminer si une patiente répond bien à la chimiothérapie ou à l’immunothérapie.
Mais, comme l’illustrent ces exemples, la mise en œuvre de la médecine de précision en milieu clinique nécessite l’identification de sous-populations spécifiques de patients. Chacune d’entre elles se caractérise par une susceptibilité identique ou équivalente au développement d’une maladie, à un comportement évolutif et/ou à une réponse à une thérapie spécifique.
Pour identifier plusieurs sous-populations de patients souffrant de la ” même ” maladie, il faut générer, intégrer et analyser des données cliniques, biologiques et/ou physiologiques à la fois sur l’état de santé et l’état pathologique des individus afin de caractériser l’évolution de la maladie d’un patient ou de mesurer l’évolution/le bénéfice d’une thérapie.
En pratique, cette approche nécessite et utilise l’identification et la validation clinique de marqueurs biologiques, physiologiques ou morphologiques. Le défi consiste à déterminer quel marqueur ou quelle combinaison de marqueurs est fiable, pertinent et spécifique à la mesure d’un processus biologique normal ou pathologique, ou à la mesure de la réponse du patient à un traitement prédéterminé.
Ces biomarqueurs peuvent être cellulaires ou moléculaires (ADN, ARN, protéines). Ils sont mesurés à partir d’une biopsie tissulaire ou d’une biopsie liquide (sang, urine…). D’autres biomarqueurs (morphologiques, etc.) peuvent également être utilisés ou mesurés par des actes radiologiques.
La Médecine guidée par les données
Comme déjà mentionné, la mise en œuvre de la médecine de précision en milieu clinique exige la production, l’intégration et l’analyse de données cliniques et biologiques/physiologiques afin de mieux comprendre les maladies et de développer et de fournir des diagnostics, des traitements et des mesures de prévention plus précis.

En d’autres termes, la médecine de précision peut être considérée comme une approche fondée sur des données appliquées à la recherche et à la médecine dans le but de mieux suivre la santé des personnes et de soigner les patients.
La médecine de précision ou la médecine guidée par les données conduira à la disponibilité de nouveaux traitements, à une meilleure utilisation de molécules innovantes et de médicaments génériques, mais aussi à des économies de coûts d’hospitalisation, en recherche biomédicale et dans l’industrie pharmaceutique.
Big Data et Intelligence Artificielle (IA)
L’intégration des données cliniques, des phénotypes, de la génomique, de la transcriptomique, de la protéomique, etc. représente un enjeu énorme et puissant pour les médecins afin d’obtenir une vision plus précise des maladies.
Néanmoins, les Big Data obtenues à partir de la génomique, de la transcriptomique, de la protéomique, etc. nécessitent aujourd’hui une structure, des logiciels et des algorithmes bioinformatiques spécifiques en raison de leur complexité et de leur volume considérable.
Par exemple, la révolution du séquençage de nouvelle génération permet aujourd’hui de générer des centaines de millions de données de séquence en un ou quelques jours alors que la méthode Sanger utilisée au début des années 2000 pouvait générer quelques dizaines de milliers de données de séquence.

De plus, 80 % des données cliniques/de patients ne sont pas structurées alors que les cliniciens ont besoin d’une vision globale pour prendre des décisions médicales. Pour mettre en œuvre la médecine de précision en milieu clinique, les acteurs de la santé ont besoin d’outils et de développement pour structurer ces grandes données et identifier les paramètres/facteurs qui pourraient avoir un comportement prédictif, clinique ou médical négatif pour le patient. La combinaison des données biologiques et cliniques, associée aux données de santé publique, est un levier fondamental pour la médecine de précision. Cependant, des défis majeurs tels que le transfert de ces données et la gestion des données privées des patients nécessitent encore le développement d’outils et de méthodes spécifiques.
Plusieurs initiatives ont vu le jour aux Etats-Unis ou en Europe pour répondre aux besoins des scientifiques en matière de traitement et d’analyse de ces nouvelles quantités massives de données, quels que soient le type et le fournisseur de ces données. Par exemple, pour faire face à ce défi complexe des technologies de l’information et des données, plusieurs organismes européens ont été rassemblés dans le cadre de l’initiative PRACE (Partnership for Advanced Computing in Europe, www.prace-ri.eu/) pour donner accès à plusieurs systèmes de calcul haute performance (HPC) de pointe (supercalculateurs) aux chercheurs et scientifiques du monde universitaire et industriel.
Comme déjà mentionné, les données biologiques issues de la génomique, de la transcriptomique, de la protéomique, etc. sont cruciales pour la médecine prédictive et de précision. Plusieurs approches incluant : le développement de nouvelles bases de données biologiques/cliniques, le développement d’algorithmes et de modèles prédictifs, l’utilisation de plateformes de datamining et d’intelligence artificielle, sont devenus les supports incontournables pour analyser les données et identifier les marqueurs qui permettront le développement de nouveaux diagnostics ou de nouvelles thérapies.
Par conséquent, dans un futur proche, l’Intelligence Artificielle (IA) et l’apprentissage machine aideront les acteurs de la santé dans leur pratique quotidienne à prendre des décisions cliniques plus éclairées et plus précises.

